20.03.2024
Anatomic Implants, ein junges Medizintechnik-Unternehmen aus Washington, DC, geht bei der Herstellung von Implantaten für Zehengelenke neue Wege und nutzt dafür die Additive Fertigung. Nach eigenen Angaben ist das 2016 gegründete Unternehmen das erste Medizintechnik-Startup, das einen Ersatz für das erste Zehengrundgelenk (MTP), der die menschliche Anatomie additiv aus Titan nahezu perfekt nachbildet, entwickelt und patentiert hat.
Die MTP-Gelenke (Metatarsophalangeal-Gelenke) verbinden die Mittelfußknochen mit den fünf Zehenknochen. Das Gelenk an der Basis des großen Zehs spielt zudem eine wichtige Rolle bei der Wahrung des Gleichgewichts. Dabei ist es häufig das erste Gelenk des Fußes, bei dem sich Arthrose entwickelt.
Um sein Produkt auf den Markt zu bringen, arbeitet Anatomic Implants mit dem französischen Hersteller von AM-Systemen Addup zusammen und nutzt eine FormUp 350 PBF-Maschine, um das Implantat für die Einreichung bei der FDA zu qualifizieren.
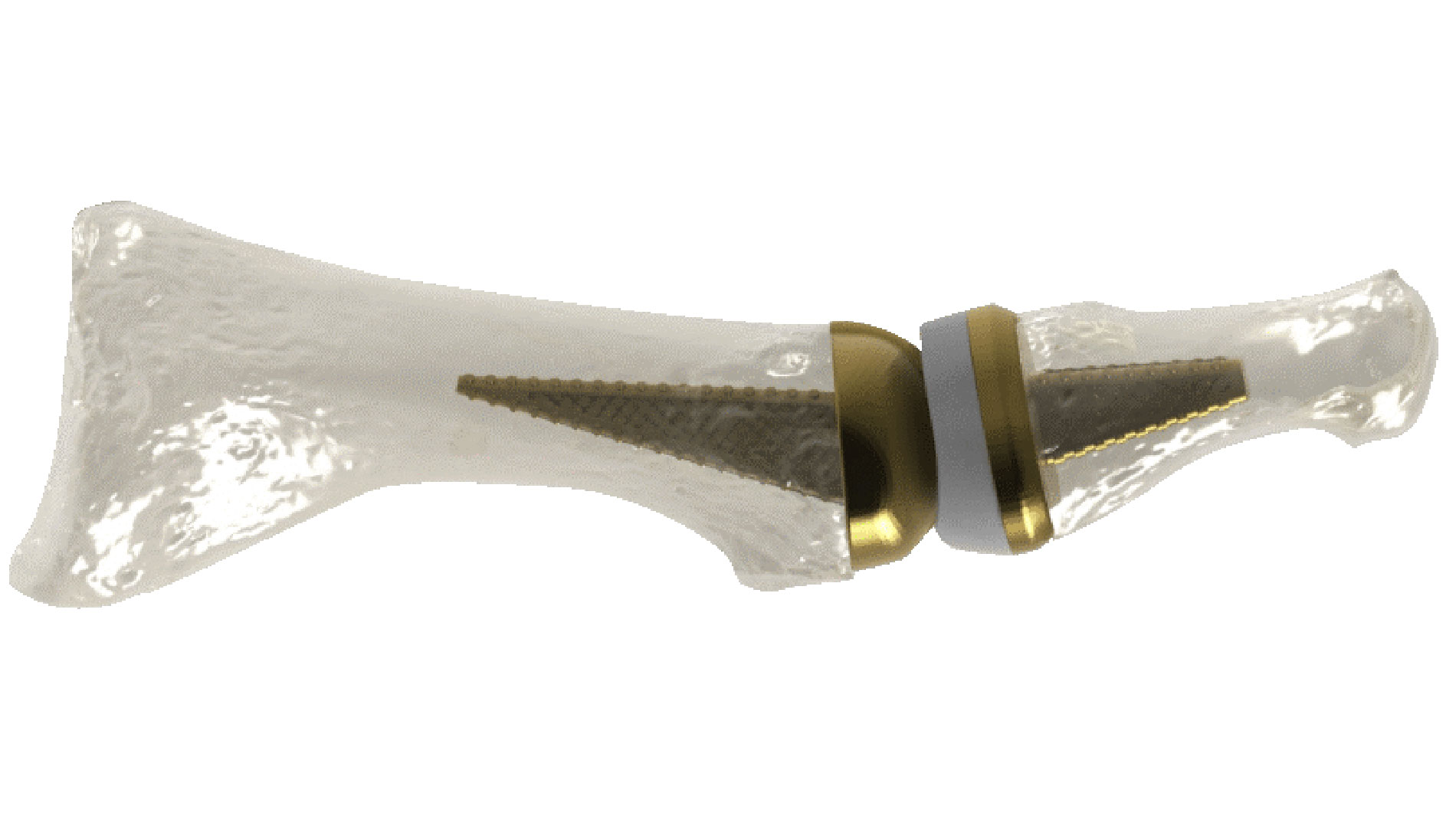
Der weltweite Markt für die Rekonstruktion des 1. MTP-Gelenks hat laut Addup ein Volumen von mehr als 500 Mio. US-Dollar pro Jahr. Der Markt sei jedoch mit sehr wenigen Produkten unterversorgt. Die vorhandenen Produkte seien zudem nicht anatomisch und hätten auch nicht das Potenzial, das Knochenwachstum so gut zu unterstützen wie ein anatomisches Großzehengelenk. Schließlich lässt sich nur durch den Einsatz der Additiven Fertigung eine poröse Struktur in das Design integrieren, um die sogenannte Osseointegration zu fördern. Durch die Osseointegration haben Implantate eine viel größere Chance, sich mit dem Knochen zu verbinden, was die Wahrscheinlichkeit einer Abstoßung des Implantats durch den Körper verringern kann.
“MTP-Gelenkersatz ist ein weitgehend unterversorgter Markt, und Medizintechnikunternehmen bauen seit Mitte der 2000er Jahre Gitterstrukturen in Implantate ein“, erklärt David Nutter, Präsident von Anatomic Implants. „Wir haben versucht, das Design besser an die Anatomie anzupassen, indem wir die neuesten Technologien der Industrie und der FDA nutzen.“
Das angestrebte 510(k)-Zulassungsverfahren beinhaltet eine umfassende Überprüfung der Sicherheits- und Leistungsdaten des Implantats. So soll festgestellt werden, ob es im Wesentlichen gleichwertig mit einem bereits auf dem Markt befindlichen Implantat ist. Da mehrere Tests bereits abgeschlossen sind, wird die 510(k)-Zulassung für Ende des dritten Quartals 2024 erwartet.
MEHR INFORMATIONEN UNTER:
Tags
- Medizintechnik
